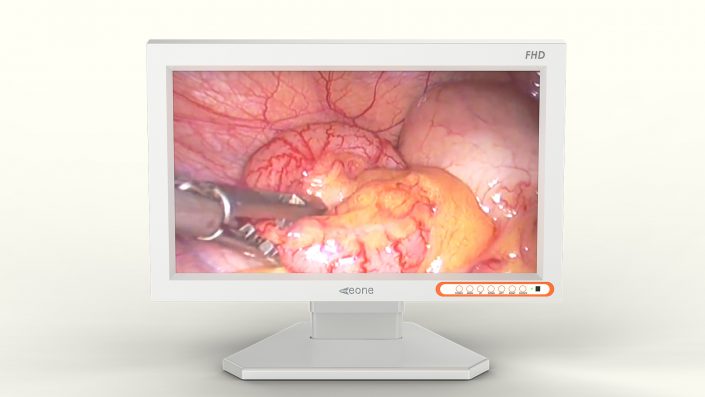
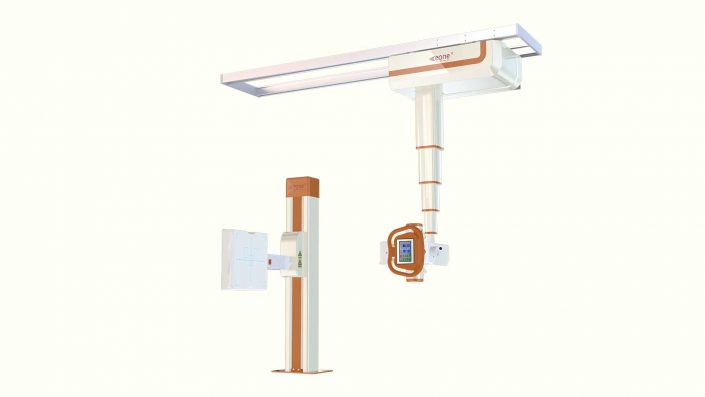
医疗影像已不局限于基础设备
医疗影像显示器市场正在经历充满积极的转变。数字化行动正在医疗市场创造机会并带来挑战,科室及各地区之间的数据和图像共享成了提升效率的主要手段。医疗影像显示器作为数字环境不可缺少的组成部分,正在面临对于图像传输日益增长的需求。
南京利昂医疗的总工程师预计2020年将上升到2.894亿美元。
由于医疗影像已不局限于基础设备,更多的用户要求观察病人检查结果。”为了观察这些影像,需要安装比原来多的医用显示器,促市场的增长,并导致销售额大幅上升。
在需求增长的同时,节省成本的要求也在增强。为此,寻求医用监视器用于手术。另外,缺乏具体的、覆盖的指导原则,也促使采取这种做法。资金有限的客户越来越认为应该安装非医用级显示器,用于浏览。这样可以为用户节省成本,但对市场参与者的生意构成重大威胁。